اثر وزیکولهای خارج سلولی مشتق از سلولهای بنیادی مزانشیمی بر پیشگیری و درمان عارضه GVHD
وزیکولهای خارج سلولی مشتق از سلولهای بنیادی مزانشیمی
وزیکولهای خارج سلولی[1] وزیکولهایی نانوسایز بوده که توسط انواع مختلفی از سلولها تولید میشوند. طبقهبندی اخیر وزیکولهای خارج سلولی بر اساس ویژگیهای بیوفیزیکی این وزیکولها است؛ نظیر، سایز، سلول منشأ، محتوای ملکولی و شیوه بیوژنز آنها. بر اساس این معیارها، وزیکولهای خارج سلولی دارای 4 دسته اصلی شامل اگزوزومها، میکرووزیکولها، اجسام آپوپتوتیک و انکوزومها هستند .
اگزوزومها جمعیت هموژنی از وزیکولها هستند که پس از ادغام اجسام مولتیوزیکولار با غشا سلولی، از سلول رها میشوند؛ سایز این ذرات بین 40 تا 150 نانومتر بوده و غنی از تترااسپنینها (مانندCD9 ،CD63 ، CD81) گانگلیوزیدها، فینگومیلین و لیپیدهای غیراشباع هستند. این ترکیبات در غشای دولایه این وزیکولها باعث میشود به تجزیه مقاوم شوند و بتوانند محتوای خود را به سلول هدف برسانند .
میکرووزیکولها مستقیما از غشا سلول به سمت بیرون جوانه زده و از سلول رها میشوند. این دسته از وزیکولهای خارج سلولی دارای هتروژنسیتی بیشتری بوده و سایز آنها بین 50 تا 2000 نانومتر میباشد. مارکرهای سطح میکرووزیکولها به مارکرهای غشایی سلولی که از منشأ گرفته اند وابسته است. به علاوه، میکرووزیکولها غنی از انواع مختلفی از پزوتئینها مانند اینتگرینها، گلیکوپروتئین Ib (GPIb ) و P-selectin میباشند .
ذرات اپوپتوتیک وزیکولهایی هستند که از قطعه قطعه شدن سلولی که تحت فرآیند آپوپتوز میباشد، تولید میشوند. ابعاد این وزیکولها بین 50 تا 5000 نانومتر بوده و دارای هیستونهای متصل شونده به DNA و فاقد گلیکوپروتئینها هستند.
در نهایت انکوزومها وزیکولهای خارج سلولی بزرگی هستند (1 تا 10 میکرومتر)که از سلولهای بدخیم نشأت میگیرند. انکوزومها، ملکولهای بیواکتیو متفاوتی را حمل میکنند؛ به عنوان مثال، فاکتورهای سیگنالینگ که در متابولیسم سلولی دخیل هستند، و متالوپروتئینازهای که میتوانند ماتریکس خارج سلولی را تجزیه کرده و در تهاجم سلولهای بدخیم به مکانهای دورتر شرکت نمایند.
وزیکولهای خارج سلولی، ارتباط بین سلولها را با اثرگذاری بر سلولهای هدف، واسطهگری کرده و فرایندهای فیزیولوژیک و پاتولوژیک را تنظیم مینمایند. این وزیکولها حاوی محتوای ژنومیکی و پروتئومیکی سلول مبدأ بوده، میتوانند به عنوان بیومارکرهای بالقوه استفاده شوند و از مایعات بیولوژیک مانند سرم و ادرار قابل دستیابی هستند. به عنوان مثال، در بدخیمیهای هماتولوژیک، EV های موجود در سرم، دارای مارکرهای سطحی مرتبط با سرطان بوده و تعدادشان ارتباط مستقیم با پارامترهای کلینیکی بیمار دارد.
پس از مشاهدات ابتدایی در زمینه کاربرد سلولهای بنیادی مزانشیمی برای سلول درمانی، پژوهشها در مورد فاکتورهای محلول ترشح شده از این سلولها افزایش یافت. به دنبال بررسی سلولهای MSC و فاکتورهای ترشحی آنها، وزیکولهای خارج سلولی آزاد شده از سلولهای MSC به عنوان عامل جدیدی در ارتباطات بین سلولی شناخته شدند . در ابتدا تصور میشد که سلولهای MSC با پیوند خوردن به بافت هدف، اثرات درمانی خود را اعمال میکنند، اما اخیرا نشان داده شده است که تنها نسبت کمی از این سلولها به بافت هدف راه پیدا میکنند. علاوه بر وجود سایتوکاینها و فاکتورهای رشد متنوعی که در سوپرناتانت کشت سلولهای MSC وجود دارد، وزیکولهای خارج سلولی نیز در این سوپرناتانت به فراوانی وجود دارند . و پژوهشهای اخیر به خوبی نشان دادهاند که سلولهای MSC چگونه از طریق آزادسازی این وزیکولها اثرات درمانی خود را اعمال مینمایند. وزیکولهای خارج سلولی مشتق از سلولهای MSC (MSC-derived EVs) به عنوان مدیاتورهای ضروری در مسیرهای سیگنالینگ فیزیولوژیک و پاتولوژیک شناخته شده و همچنین بسیاری از اثرات درمانی سلولهای MSC نیز به این وزیکولها نسبت داده میشود. در مدلهای In vitro و in vivo نشان داده شده است که این وزیکولها قابلیت تعدیل سیستم ایمنی را دارند که این اثرات غالبا به واسطه پروتئینها و نوکلئیک اسیدهای درون آنها اعمال میگردد . استفاده از وزیکولهای خارج سلولی، نسبت به خود سلولها دارای مزیتهای میباشد:
- بسیاری از نگرانیهای مربوط به سلولدرمانی، با استفاده از این وزیکولها از بین خواهد رفت؛ به عنوان مثال، احتمال آلودگی سلولی با سلولهای انکوژنیک و تقسیم سلولی خارج از کنترل
- قابلیت دستکاریهای متعدد بر روی وزیکولهای خارج سلولی در جهت بهبود فرآیند انتقال آنها و اعمال اثرات مورد نظر
- کاهش میزان استفاده از سلولهای MSC برای بدست آوردن محصولات درمانی (چرا که اکثر روشهای دستیابی به این سلولها تهاجمی است
- جلوگیری از احتمال رد سلولهای MSC توسط سیستم ایمنی میزبان و یا ایجاد بافتهای اکتوپیک توسط این سلولها
- مدیریت کردن EV ها نسبت به خود سلولها آسانتر است؛ به نظر میرسد فرآیندهای فریز، ذوب و ذخیره برایEV ها به نسبت سلولها کمتر ضروری است
- به علت اینکه EV ها دارای فعالیت متابولیک نیستند، نسبت به سلولها کمتر دستخوش تغییرات ناشی از محیط شده و همین امر باعث میشود که بتوان فعالیتهای بیولوژیک و ویژگیهای عملکردی آنها را به صورت دقیقتر اندازهگیری کرد
وزیکولهای خارج سلولی مشتق از سلولهای MSC میتوانند با استفاده از مایعات خارج سلولی به مکانهای دورتر راه پیداکرده و پاسخهای ایمنی و یا بازسازی بافت را با مکانیسمهای متفاوت تسهیل نمایند؛ به عنوان مثال این وزیکولها میتوانند با گیرندههای خاصی در سطح غشا سلول هدف ارتباط برقرار کنند و یا بهصورت مستقیم با غشا سلول هدف ادغام شوند و عوامل بیولوژیک درون خود را به درون سیتوزول سلول هدف آزاد سازند .
مطالعات پیشبالینی نشان دادهاند که وزیکولهای خارج سلولی مشتق از سلولهای MSC دارای اثرات درمانی قابل مقایسه و حتی بهتر نسبت به سلولهای MSC هستند .
MSC-EV ها بهطرز چشمگیری میتوانند مرگ سلولی در بافت التهابی را از طریق کاهش بیان ژن پروآپوپتوتیک Bax و افزایش بیان فاکتور ضدآپوپتوتیک Bcl-2 کاهش دهند. سایر مکانیسمهای دخیل در کنترل التهاب توسطMSC-EVs ، عبارتست از مهار تکثیر سلولهای CD4+ و CD8+ توسطTGFβ ، IDO و تنظیم میانکنش بینIL-1/IL-1R ، القا سلولهای دندریتیک تولرژنیک و گسترش سلولهای Treg
ویژگیها و محتوای درونی وزیکولهای خارج سلولی مشتق از سلولهای MSC
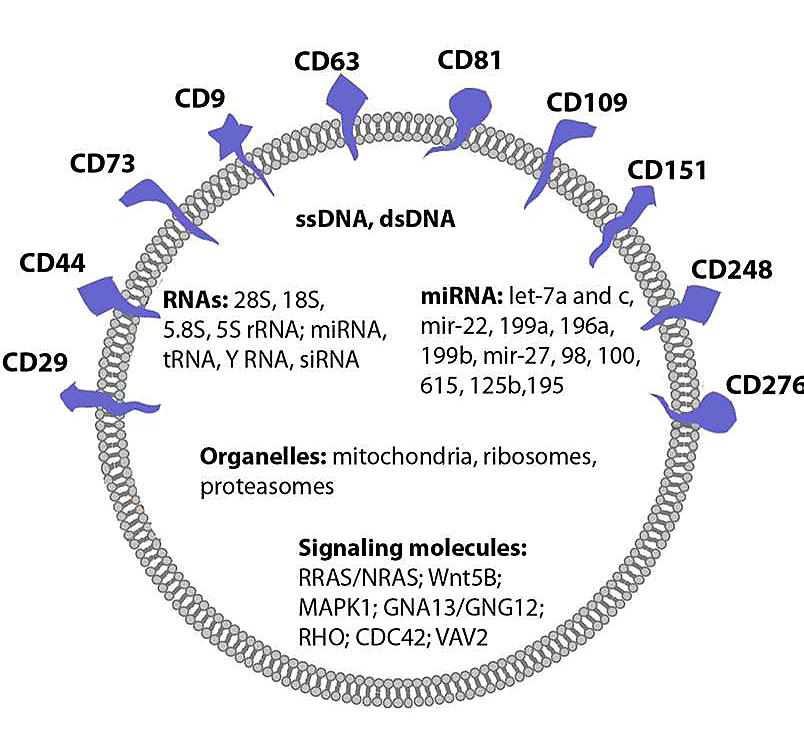
تولید وزیکولهای خارج سلولی توسط سلولهای MSC به خوبی نشان داده شده است. وزیکولهای خارج سلولی مشتق از سلولهای MSC دارای مارکرهای سطحی معمول مانند CD107 ، CD63 ، CD9 و CD81 بوده و علاوه بر این مارکرها دارای مارکرهای مربوط به سلولهای MSC نیز میباشند؛ مانندCD29 ،CD73 ، CD44 وCD105 چندین مطالعه محتوای نوکلئیک اسیدها و پروتئینهای MSC-EV ها را که در نهایت به سلول هدف منتقل میشوند، آنالیز کردهاند. مطالعات نشان دادهاند که درون MSC-EV ها انواع مختلفی از RNA ها وجود دارد، به ویژه، RNA های رونویسی که در کنترل تکثیر، رونویسی و تنظیم ایمنی نقش دارند. به علاوه، MSC-EV ها، دارای انواع خاصی از microRNA نیز هستند، مانند miR-223 ، miR-564 و miR-451که در بقا سلولی، تمایز سلولی و تنظیم ایمنی نقش دارند . آنالیز پروتئوم MSC-EV ها نشان داده است که برخی از پروتئینهای سیتوپلاسمی (مانند PDGFRB ،EGFR ، PLAUR) و همچنین ملکلولهای سیگنالینگ (مانند RRAS/NRAS ، MAPK1،GNA13/GNG12 ،Cdc42 ، VAV2) و مولکولهای چسبندگی (مانندFN1 ،EZR ،IQGAP1 ،CD47 ، LGALS1/LGALS3 ) نیز درون این وزیکولها وجود دارند.. تحلیل عملکرد پروتئینهای موجود در MSC-EV ها نشان داده است که این پروتئینها در فرایندهای سلولی شامل تکثیر سلولی، چسبندگی، مهاجرت و مورفوژنز مشارکت میکنند. وزیکولهای خارج سلولی با استفاده از محتوایشان رابطه بین سلولی را برقرار کرده و میتوانند در سلول هدفشان تغییرات اساسی ایجاد کنند.
علیرغم نتایج امیدبخش در پژوهشهای مرتبط باMSC-EVs ، مکانیسم دقیقی که این وزیکولها بوسیله آن با سیستم ایمنی ارتباط برقرار میکنند، ناشناخته است. درک هرچه بیشتر و بهتر مکانیسم عملکرد MSC-EV ها سبب بهبود و استانداردسازی روشهای درمانی مبتنی بر این وزیکولها خواهد شد. به علاوه، با غنی کردن محتوای درونی این وزیکولها با ملکولهای معینی که متناسب با نوع بیماری و شرایط بالینی بیمار است، میتوان نتایج متغیر در پاسخ دهی بیماران در این روش درمانی را کاهش داد .
استفاده از MSC-EVs در پیشگیری و درمان GVHD
به علت ظرفیت تعدیل کنندگی ایمنی MSC-EV ها، این وزیکولها میتوانند سیستم ایمنی فعال را تضعیف کنند و یا از واکنشهای ایمنی نامطلوب( مانند آنچه در GVHD رخ میدهد) جلوگیری کنند.
در زمینه استفاده از MSC-EV مسائلی همچون منبع سلولهای مزانشیمی (بافتهای بالغین یا بافت های جنینی)، روش جداسازی و خالص کردن EV ها و تعیین ویژگیهای آنها، دوز مورد استفاده در شرایط بالینی و ارزیابی کارایی این وزیکولها قبل از استفاده بایستی مورد توجه قرار گیرند. وزیکولهای خارج سلولی مشتق از سلولهای بنیادی مزانشیمی، با انتقالmicroRNA ، mRNA ،lncRNA ، پروتئین، لیپید و سایر ملکولهای بیواکتیو نقش قابل توجهی در ارتباطات بین سلولهای MSC و سایر سلولها ایفا میکنند..
در مورد اثربخشی سلولهای MSC در زمینه پیشگیری و درمان عارضه GVHD گزارشات زیادی وجود دارد؛ با اینحال، در مورد اثربخشی استفاده از MSC-EV ها در این عارضه گزارشها محدود است که در زیر به آنها اشاره میشود:
در سال2014، Kordelas و همکارانش طی یک پژوهش نشان دادند که تزریق MSC-EV به یک بیمار مبتلا به GVHD مقاوم به استروئید درمانی، دارای اثر بخشی کافی بوده و یک روش امن است؛ EV ها قبل از استفاده آنالیز شده و وجود مقادیر زیادی IL-10 ، TGFβ و HLA-G در آنها تأیید شد. برای کاهش عوارض احتمالی، وزیکولها به صورت 7 دوز در طول دو هفته به بیمار تزریق شدند. در انتهای فرآیند تزریق EV ها، آزمایشاتIn vitro ، کاهش تولید سایتوکاینهای التهابی توسط سلولهای تک هستهای خون محیطی (PBMCs) بیمار را نشان دادند. کاهش فعالیت سلولهای PBMC در بدن بیمار باعث کاهش سایتوکاینهای پیشالتهابی در سرم و بهبود قابل توجه علائم بالینی بیمار شد. انتشار نتایج این پژوهش سبب ادامه پژوهشها با تمرکز بر پیشگیری یا درمان GVHD با استفاده از EV ها شد.
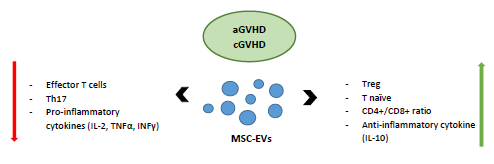
وزیکولهای خارج سلولی در پیشگیری از عارضه aGVHD بعد از پیوند سلولهای بنیادی هماتوپوئیتیک آلوژنیک در یک مدل موشی استفاده شدند؛ برای جلوگیری از مرگ و میر به دنبالaGVHD ، در این مدل حیوانی، وزیکولهای خارج سلولی بدست آمده از بندناف انسان بهصورت داخل رگی به موش تزریق شدند. تزریقات در همان روز پیوند و در روز هفتم پس از پیوند انجام و توسعه aGVHDو بقای موش تحت نظارت قرار گرفت. این موشها نسبت به جمعیت کنترل دارای تعداد کمتری از سلولهای CD3+ CD8+ سیتوتوکسیک بوده و سطح سرمیIL-2 ، TNFα و INFγ در آنها کاهش یافته بود. این نتایج، بوسیله آزمایشات In vitro نیز، با اندازهگیری اثرات ایمنوساپرسیو این وزیکولها بر تکثیر سلولهای T تحریک شده با میتوژن به تأیید رسید. این پژوهش نشان داد که اثر ایمنوساپرسیو UC-MSC-EVهای انسانی در پیشگیری از ایجادaGVHD ، عمدتا از طریق سرکوب تکثیر سلولهای T آلوریاکتیو، مهار ترشح سایتوکاینهای پیشالتهابی، تغییر زیرجمعیتهای سلولهای T و القای تولید سایتوکاینهای ضدالتهابی میباشد.
تظاهرات ایمنولوژیک یک موش با عارضهaGVHD ، بعد از تزریق وزیکولهای خارج سلوی مشتق از سلولهای بنیادی مزانشیمی مغز استخوان (BM-MSC-EVs) (بدست آمده از مغز استخوان انسان) توسط Fujii و همکارانش ارزیابی و توصیف شد. در این مطالعه، بیان سایتوکاینها، کموکاینها، فاکتورهای رشد، microRNA ها در درون وزیکولها اندازهگیری شد. miR-125a-3p در میان 10 microRNA افزایش یافته در درون این وزیکولها، بیشترین افزایش را نشان داد. این مطالعه نشان داد که تعداد و درصد سلولهای T CD4+ و T CD8+ با فنوتیپ اجرایی کاهش و سلولهای T بکر افزایش یافتهاند. به علاوه، موشهای تحت درمان با این وزیکولها دارای تعداد بیشتری از سلولهای Treg بودند که منجر به این نتیجهگیری شد که تزریق سیستمیک BM-MSC-EV در aGVHD میتواند سلولهای T اجرایی را کاهش و سلولهای Treg را افزایش دهد.
اثرات سودمند تزریق MSC-EV در یک مدل موشی با پیوند زنوژنیک نیز نشان داده شده است؛ در این مطالعه، سلولهای PBMC انسانی به موش اشعه دیده تزریق شده و MSC-EV های مشتق از جنین انسان نیز یک روز بعد از سلولهایPBMC ، بهصورت داخل پریتونئالی به موش تزریق شد. دوزهای بعدی نیز هر سه روز یکبار تا زمان مرگ حیوان یا پایان مطالعه به موش تزریق میشدند . نتایج این مطالعه نشان داد که کاهش علائم GVHD و افزایش بقا موش گیرنده در ارتباط با افزایش سلولهای Treg در گردش خون موش میباشد. در همین راستا این فرضیه بوجود آمد که یک مکانیسم احتمالی در عملکرد این وزیکولها در زمینه تعدیل ایمنی، افزایش سلولهای T تنظیمی است. به علاوه در این مطالعه مشاهده شد که القای سلولهای Treg بوسیله اگزوزومها نیازمند فعال شدن سلولهای T توسط سلولهای APC میباشد که توسط آزمایشات in vitro و in vivo نشان داده شد.
اثرات درمانی وزیکولهای خارج سلولی در یک مدل موشی درگیر cGVHD نیز نشان داده شده است؛ وزیکولهای خارج سلولی مشتق از سلولهای بنیادی مزانشیمی مغز استخوان انسان برای شش هفته، یکبار در هفته به موش تزریق شدند. علائم بالینی و آنالیزهای هیستولوژیک همراه با جنبههای ایمونولوژیک عارضه cGVHD در موش مورد ارزیابی قرار گرفت. موشهایی که با این وزیکولها تحت درمان قرار گرفته بودند میزان بقای طولانیتر، همراه با بهبود علائم پوستی، ریوی و کبدی را نشان دادند. در موشهای دریافت کنندهEVs ، فعالیت سلولهای T CD4+ و انفیلتراسیون آنها به ریه کاهش یافته بود.
در یک مطالعهIn vitro ، همکشتی سلولهای PBMC یک بیمار مبتلا به cGVHD و وزیکولهای خارج سلولی مشتق از سلولهای بنیادی مزانشیمی مغز استخوان، مهار سلولهای Th17 و القای سلولهای Treg را نشان داد.
تاکنون تنها یک مطالعه اثر MSC-EV های مشتق از بند ناف را در جهت پیشگیری از GVHD حاد بررسی کرده است. در این مطالعه استفاده از UC-MSC-EV یک جایگزین ایدهآل در درمان موشهای مواجه شده با عارضه GVHD پس از پیوند آلوژنیک HSCT بوده است. موشهای درمان شده با UC-MSC-EV به طرز قابل توجهی دارای تعداد کمتری از لنفوسیتهای T CD3+ CD8+، سطح سرمی پایینترIL-2 ، TNFα وINFγ ، سطح سرمی بالاتر از IL-10 و همچنین نسبت بالاتری از CD4+/CD8+ بودند. یک مطالعه In vitro نیز نشان داده است که UC-MSC-EV ها میتوانند پرولیفراسیون القا شده توسط میتوژن در اسپلنوسیتها را مهار نمایند و این اثر آنها وابسته به دوز نیز میباشد و قادر است اثراتی مشابه با مطالعات In vivo بر میزان سایتوکاینها داشته باشد .
بهطور خلاصه میتوان گفت که MSC-EV ها همانند سلولهای MSC میتوانند با کاهش سلولهای T فعال، القای سلولهای T تنظیمی، کاهش سایتوکاینهای پیشالتهابی و افزایش سایتوکاینهای ضدالتهابی در درمان عارضه GVHDمؤثر و کارآمد باشند.
بافتی که سلولهای MSC از آن منشأ میگیرند ممکن است بر محتوای درون وزیکولهای خارج سلولی مشتق از این سلولها اثر بگذارد. EV های مشتق شده از سلولهای MSC بدست آمده از بافتهای مختلف ممکن است پتانسیلهای درمانی متفاوتی برای بیماریهای مختلف نشان دهند.
وزیکولهای خارج سلولی مشتق از سلولهای بنیادی مزانشیمی مغز استخوان، رایجترین منبع برای سلولهای MSC است. علاوه بر پتانسیل درمانی این وزیکولها در درمان بیماریهای مرتبط با استخوان، غضروف، تاندونها و بیماریهای کلیوی، یکی از کاربردهای آنها در درمان عارضه GVHD است. تزریق سیستمیک hBM-MSC-EVs سبب بقای طولانیتر مدلهای موشی aGVHD و کاهش عوارض پاتولوژیک در بافتهای مورد هدف این عارضه میشود. این اثرات، ناشی از توانایی این وزیکولها در سرکوب سیستم ایمنی میباشد. این وزیکولها باعث مهار سلولهای T CD4+ و CD8+ میشوند و علاوه براینکه تمایز سلولهای T به سمت سلولهای T اجرایی را متوقف میکنند، باعث ایجاد فنوتیپهای تنظیمی از این سلولها نیز میشوند .
در چندین مطالعه که به مقایسه وزیکولهای خارج سلولی مشتق از سلولهای MSC بدست آمده از مغز استخوان و بندناف پرداختهاند، نشان داده شده است که EV های مشتق از این دو نوع سلولMSC ، از نظر ویژگیهای فیزیکی و محتوای درونیشان تقریبا یکسان هستند (به ویژه در مورد فاکتور هایی که اعمال ایمنومدولاتوری دارند) با اینحال، یک تفاوت آشکار بین این دو منبع این است که سلولهای MSC بدست آمده از بندناف، میزان بیشتری از EV تولید میکنند .
وزیکولهای خارج سلولی مشتق از سلولهای MSC بدست آمده از بافت آدیپوز نیز دارای اثرات مشابه با سایر منابع MSC دارند. با اینحال، هنگامیکه استخراج EV ها از سایر باقتها با دشواری همراه باشد و یا برای درمان مناسب نباشند، AD-EV ها جایگزینهای مناسبی هستند و منابع در دسترستری به شمار میآیند.
واحد تضمین کیفیت بانک خون بندناف رویان /
منابع:
- Amorin B, Alegretti AP, Valim V, Pezzi A, Laureano AM, da Silva MA, et al. Mesenchymal stem cell therapy and acute graft-versus-host disease: a review. Hum Cell. 2014;27(4):137-50.
- De Luca L, Trino S, Laurenzana I, Lamorte D, Caivano A, Del Vecchio L, et al. Mesenchymal Stem Cell Derived Extracellular Vesicles: A Role in Hematopoietic Transplantation? Int J Mol Sci. 2017;18
- Yaghoubi Y, Movassaghpour A, Zamani M, Talebi M, Mehdizadeh A, Yousefi M. Human umbilical cord mesenchymal stem cells derived-exosomes in diseases treatment. Life Sci. 2019;233:116733.
- Börger V, Bremer M, Ferrer-Tur R, Gockeln L, Stambouli O, Becic A, et al. Mesenchymal Stem/Stromal Cell-Derived Extracellular Vesicles and Their Potential as Novel Immunomodulatory Therapeutic Agents. Int J Mol Sci. 2017;18
- Giebel B, Kordelas L, Börger V. Clinical potential of mesenchymal stem/stromal cell-derived extracellular vesicles. Stem Cell Investig. 2017;4:84.
- González-González A, García-Sánchez D, Dotta M, Rodríguez-Rey JC, Pérez-Campo FM. Mesenchymal stem cells secretome: The cornerstone of cell-free regenerative medicine. World J Stem Cells. 2020;12(12):1529-52.
- Naserian S, Leclerc M, Shamdani S, Uzan G. Current Preventions and Treatments of aGVHD: From Pharmacological Prophylaxis to Innovative Therapies. Front Immunol. 2020;11:607030.
- Godoy JAP, Paiva RMA, Souza AM, Kondo AT, Kutner JM, Okamoto OK. Clinical Translation of Mesenchymal Stromal Cell Therapy for Graft Versus Host Disease. Front Cell Dev Biol. 2019 75255.;
- Song Y, Lim JY, Lim T, Im KI, Kim N, Nam YS, et al. Human mesenchymal stem cells derived from umbilical cord and bone marrow exert immunomodulatory effects in different mechanisms. World J Stem Cells. 2020;12(9):1032-49.
- Wang M, Yuan Q, Xie L. Mesenchymal Stem Cell-Based Immunomodulation: Properties and Clinical Application. Stem Cells Int. 2018;2018:3057624.
- Qi K, Li N, Zhang Z, Melino G. Tissue regeneration: The crosstalk between mesenchymal stem cells and immune response. Cell Immunol 93.-326586;2118 .
- Massa M, Croce S, Campanelli R, Abbà C, Lenta E, Valsecchi C, et al. Clinical Applications of Mesenchymal Stem/Stromal Cell Derived Extracellular Vesicles: Therapeutic Potential of an Acellular Product. Diagnostics (Basel). 2020;10
- Dabrowska S, Andrzejewska A, Janowski M, Lukomska B. Immunomodulatory and Regenerative Effects of Mesenchymal Stem Cells and Extracellular Vesicles: Therapeutic Outlook for Inflammatory and Degenerative Diseases. Front Immunol. 2020;11:591065.
[1] Extracellular vesicles